Эстрогены: для чего нужны «женские» гормоны и как регулировать их уровень в организме
Гормоны — это биологически активные вещества органической природы, которые вырабатываются эндокринными железами. Поступая в кровь, гормоны оказывают регулирующее воздействие на работу всего организма, в частности, на обмен веществ и физиологические функции. Одним из важнейших гормонов является эстроген. На что влияет эстроген и к чему может привести его недостаток и переизбыток, расскажем в статье.
Что за гормон такой — эстроген?
Термином «эстроген» обозначен целый подкласс стероидных женских половых гормонов, которые вырабатываются в основном фолликулярным аппаратом яичников. Существует три типа эстрогенов: эстрадиол, эстриол и эстрон. К слову, такие гормоны содержатся и в мужском организме, там за их выработку отвечают яички, кора надпочечников и внегонадные ткани. Но так как у мужчин гормоны эстрогены вырабатываются в минимальном количестве, их принято считать женскими.
За что отвечает гормон эстроген у женщин? Проще сказать, за что он не отвечает. Выработка эстрогена влияет на:
- Развитие и функционирование репродуктивной системы. Эстроген стимулирует развитие матки и маточных труб, а также влагалища, стромы и протоковых молочных желез. Благодаря женским гормонам эстрогенам у девочек в подростковом возрасте появляются вторичные половые признаки и начинается менструация — именно эстроген способствует регулярному отторжению эндометрия из матки.
- Кровеносную систему. Гормон эстроген повышает в крови концентрацию железа, меди и тироксина. Кроме того, он оказывает антисклеротическое действие, способствует увеличению количества в плазме липопротеинов высокой плотности, которые снижают риск атеросклероза и различных заболеваний сердечно-сосудистой системы. Также «женский» гормон снижает содержание липопротеинов низкой плотности, которые являются одними из основных переносчиков холестерина.
- Рост и восстановление костной ткани. Эстроген в организме предотвращает вымывание кальция, защищает ткани суставов и стимулирует восстановление клеток костной ткани.
- Эластичность кожных покровов. «Женский» гормон способствует активизации выработки коллагена, от которого зависит упругость кожи.
- Память и психоэмоциональное состояние. Рецепторы эстрогена сконцентрированы в областях мозга, отвечающих за усвоение информации, а также за настроение и эмоции.
Одним словом, эстроген — это ключевой фактор поддержания женского здоровья и красоты. К слову, он влияет и на либидо у женщин, которое тоже имеет большое значение для счастливой жизни. Данный гормон напрямую связан и с общим самочувствием представительниц прекрасного пола. Женщина с нормальным уровнем гормона эстрогена менее раздражительна, у нее нет отеков, беспричинных головных болей и проблем с лишним весом.
Какова норма эстрогена у женщин? В период репродуктивного возраста данный показатель меняется в зависимости от фазы менструального цикла. Во время первой фазы содержание эстрона составляет 5–9 нг%, а эстрадиола — 15–60 нг/л. Однако с наступлением второй фазы, когда начинается овуляция, показатели повышаются до 3–25 нг% и 27–246 нг/л соответственно. При беременности цифры и вовсе увеличиваются многократно: концентрация эстрона находится в диапазоне 1500–3000 нг%, а эстрадиола — 17 000–18 000 нг/л. Примерно за десять лет до наступления менопаузы уровень эстрогенов начинает постепенно понижаться. Именно поэтому женщинам после 35 лет, которые планируют беременность, врачи рекомендуют сдавать анализы крови на гормоны. Что касается эстрогенов при климаксе, то в этом возрастном периоде показатель эстрадиола составляет в среднем 5–30 нг/л.
К чему могут привести недостаток или переизбыток эстрогена
Как уже понятно, от уровня эстрогена в крови напрямую зависит физическое и психологическое состояние женщины, поэтому очень важно следить за данным показателем и принимать меры при любом дисбалансе.
Последствия падения уровня эстрогенов:
- различные боли, в основном головные и сердечные, а также болезненные ощущения в пояснице, спине;
- ухудшение терморегуляции, в частности, приливы жара;
- хрупкость костей;
- сужение сосудов;
- ухудшение памяти;
- появление морщин;
- колебания эмоционального фона.
При избытке эстрогенов у женщин возникают:
- различные воспаления;
- вздутие живота;
- повышение давления;
- агрессия, раздражительность и проблемы со сном;
- всевозможные боли.
Причин снижения и повышения эстрогена в организме женщины несколько. Это может быть расстройство функционирования гипофиза, несбалансированное питание, слишком высокие физические нагрузки, менопауза и предшествующий ей период.
Избыток эстрогена встречается нечасто, обычно приходится корректировать именно нехватку данного гормона. Самая распространенная ее причина — возрастные изменения в женском организме, которые начинаются после 40 лет. Избежать их и обеспечить себе вечную молодость, к сожалению, невозможно, но есть способы замедлить подобные процессы.
Что можно сделать, если эстрогенов не хватает?
Недостаток естественных эстрогенов можно частично компенсировать приемом фитоэстрогенов. Это натуральные вещества растительного происхождения. Наиболее изученным из них является генистеин. Он проявляет аналогичную натуральным эстрогенам активность, способствует укреплению костей за счет поддержания процессов формирования и минерализации костной ткани, играет важную роль в сохранении здоровья суставов, регулируя обменные процессы в клетках суставного хряща. К слову, минерализация костной ткани также снижает риск возникновения опасного заболевания — остеопороза.
Хрупкость костей — один из самых опасных симптомов нехватки эстрогена, повышающий риск переломов и прочих травм. Именно поэтому для поддержания здоровья костей женщинам элегантного возраста рекомендуется принимать кальций. Он содержится в зеленом горошке, бобах, сельдерее, свежих огурцах, редисе и капусте. Также получить необходимое количество кальция может помочь витаминные комплексы.
Мало кто из женщин спокойно отнесется к появлению морщин: обычно это приводит к ухудшению настроения, нежеланию смотреться в зеркало и даже к мыслям о грядущей старости. Однако сдаваться рано: генистеин способен активировать выработку собственного коллагена, защитить кожу от фотостарения и, как следствие, сохранить привлекательность.
Любые неприятные симптомы — повод обратиться к врачу, даже если вы считаете, что это «всего лишь» проявления климакса и поделать с ними ничего нельзя. Вполне вероятно, что организм таким образом сигнализирует о болезни, а своевременная диагностика поможет в излечении. Если дело действительно в возрастной гормональной перестройке, то и с ней можно бороться. Конечно, молодильные яблоки бывают только в сказках, но прием правильно подобранных препаратов способен повысить уровень эстрогена в крови, а значит, замедлить климактерические изменения.
Комплекс с фитоэстрогенами и кальцием специально для женщин
«Компливит® Кальций Д3 ГОЛД» — витаминно-минеральный комплекс, помогающий нормализовать самочувствие женщины после 40 лет, когда уровень эстрогена начинает активно снижаться. Комплекс разработан с учетом возрастных гормональных изменений в женском организме. В его состав входит фитоэстроген генистеин, действие которого усилено кальцием и витаминами D3 и К1. Поэтому «Компливит® Кальций Д3 ГОЛД» используется в качестве средства и для укрепления костей, и для предотвращения вымывания кальция.
Генистеин, содержащийся в препарате, производится в Швейцарии по запатентованной технологии: он отличается чистотой и обладает высоким уровнем активности субстанции. Генистеин в витаминно-минеральном комплексе не вызывает в женском организме нежелательных явлений, характерных для большинства фитоэстрогенов. «Компливит® Кальций Д3 ГОЛД» на 15–20% эффективнее для укрепления костей по сравнению с простой комбинацией кальция и витамина D. Помимо этого, он способствует улучшению сна и снижению раздражительности. «Компливит® Кальций Д3 ГОЛД» способен поддерживать здоровье суставов, регулировать метаболизм в клетках суставного хряща, а также активизировать выработку коллагена и обеспечивать защиту кожи от фотостарения «изнутри».
Для достижения эффекта достаточно принимать по одной таблетке данного препарата в день.
* Свидетельство о государственной регистрации №RU.77.99.11.003.Е.003721.04.14 от 18 апреля 2014 года.
Источник статьи: http://www.pravda.ru/navigator/iestrogen-u-zhenshchin.html
Эстрогены и поджелудочная железа
Поджелудочная железа относится к железам со смешанной функцией. Эндокринная функция осуществляется за счет продукции гормонов панкреатическими островками (островками Лангерганса). Островки расположены преимущественно в хвостовой части железы, и небольшое их количество находится в головном отделе. В островках имеется несколько типов клеток: a, b, d, G и ПП. a-Клетки вырабатывают глюкагон, b-клетки продуцируют инсулин, d-клетки синтезируют соматостатин, который угнетает секрецию инсулина и глюкагона. G-клетки вырабатывают гастрин, в ПП-клетках происходит выработка небольшого количества панкреатического полипептида, являющегося антагонистом холецистокинина. Основную массу составляют b-клетки, вырабатывающие инсулин.
Инсулин влияет на все виды обмена веществ, но прежде всего на углеводный. Под воздействием инсулина происходит уменьшение концентрации глюкозы в плазме крови (гипогликемия). Это связано с тем, что инсулин способствует превращению глюкозы в гликоген в печени и мышцах (гликогенез). Он активирует ферменты, участвующие в превращении глюкозы в гликоген печени, и ингибирует ферменты, расщепляющие гликоген. Инсулин также повышает проницаемость клеточной мембраны для глюкозы, что усиливает ее утилизацию. Кроме того, инсулин угнетает активность ферментов, обеспечивающих глюконеогенез, за счет чего тормозится образование глюкозы из аминокислот. Инсулин стимулирует синтез белка из аминокислот и уменьшает катаболизм белка. Инсулин регулирует жировой обмен, усиливая процессы липогенеза: способствует образованию жирных кислот из продуктов углеводного обмена, тормозит мобилизацию жира из жировой ткани и способствует отложению жира в жировых депо.
Образование инсулина регулируется уровнем глюкозы в плазме крови. Гипергликемия способствует увеличению выработки инсулина, гипогликемия уменьшает образование и поступление гормона в кровь. Некоторые гормоны желудочно-кишечного тракта, такие как желудочный ингибирующий пептид, холецистокинин, секретин, увеличивают выход инсулина. Блуждающий нерв и ацетилхолин усиливают продукцию инсулина, симпатические нервы и норадреналин подавляют секрецию инсулина.
Антагонистами инсулина по характеру действия на углеводный обмен являются глюкагон, АКТГ, соматотропин, глюкокортикоиды, адреналин, тироксин. Введение этих гормонов вызывает гипергликемию.
Недостаточная секреция инсулина приводит к заболеванию, которое получило название сахарного диабета. Основными симптомами этого заболевания являются гилергликемия, глюкозурия, полиурия, полидипсия. У больных сахарным диабетом нарушается не только углеводный, но и белковый и жировой обмен. Усиливается липолиз с образованием большого количества несвязанных жирных кислот, происходит синтез кетоновых тел. Катаболизм белка приводит к снижению массы тела. Интенсивное образование кислых продуктов расщепления жиров и дезаминирования аминокислот в печени могут вызвать сдвиг реакции крови в сторону ацидоза и развитие гипергликемической диабетической комы, которая проявляется потерей сознания, нарушениями дыхания и кровообращения.
Избыточное содержание инсулина в крови (например, при опухоли островковых клеток или при передозировке экзогенного инсулина) вызывает гипогликемию и может привести к нарушению энергетического обеспечения мозга и потере сознания (гипогликемической коме).
a-Клетки островков Лангерганса синтезируют глюкагон, который является антагонистом инсулина. Под влиянием глюкагона происходит распад гликогена в печени до глюкозы. В результате этого повышается содержание глюкозы в крови. Глюкагон способствует мобилизации жира из жировых депо. Секреция глюкагона также зависит от концентрации глюкозы в крови. Гипергликемия тормозит образование глюкагона, гипогликемия, напротив, увеличивает.
Половые железы, или гонады — семенники (яички) у мужчин и яичники у женщин относятся к числу желез со смешанной секрецией. Внешняя секреция связана с образованием мужских и женских половых клеток — сперматозоидов и яйцеклеток. Внутрисекреторная функция заключается в секреции мужских и женских половых гормонов и их выделении в кровь. Как семенники, так и яичники синтезируют и мужские и женские половые гормоны, но у мужчин значительно преобладают андрогены, а у женщин — эстрогены. Половые гормоны способствуют эмбриональной дифференцировке, в последующем развитию половых органов и появлению вторичных половых признаков, определяют половое созревание и поведение человека. В женском организме половые гормоны регулируют овариально-менструальный цикл, а также обеспечивают нормальное протекание беременности и подготовку молочных желез к секреции молока.
Мужские половые гормоны (андрогены)
Интерстициальные клетки яичек (клетки Лейдига) вырабатывают мужские половые гормоны. В небольшом количестве они также вырабатываются в сетчатой зоне коры надпочечников у мужчин и женщин и в наружном слое яичников у женщин. Все половые гормоны являются стероидами и синтезируются из одного предшественника — холестерина. Наиболее важным из андрогенов является тестостерон. Тестостерон разрушается в печени, а его метаболиты экскретируются с мочой в виде 17-кетостероидов. Концентрация тестостерона в плазме крови имеет суточные колебания. Максимальный уровень отмечается в 7-9 часов утра, минимальный — с 24 до 3 часов.
Тестостерон участвует в половой дифференцировке гонады и обеспечивает развитие первичных (рост полового члена и яичек) и вторичных (мужской тип оволосения, низкий голос, характерное строение тела, особенности психики и поведения) половых признаков, появление половых рефлексов. Гормон участвует и в созревании мужских половых клеток — сперматозоидов, которые образуются в сперматогенных эпителиальных клетках семенных канальцев.
Тестостерон обладает выраженным анаболическим действием, т.е. увеличивает синтез белка, особенно в мышцах, что приводит к увеличению мышечной массы, к ускорению процессов роста и физического развития. За счет ускорения образования белковой матрицы кости, а также отложения в ней солей кальция гормон обеспечивает рост, толщину и прочность кости. Способствуя окостенению эпифизарных хрящей, половые гормоны практически останавливают рост костей. Тестостерон уменьшает содержание жира в организме. Гормон стимулирует эритропоэз, чем объясняется большее количество эритроцитов у мужчин, чем у женщин. Тестостерон оказывает влияние на деятельность центральной нервной системы, определяя половое поведение и типичные психофизиологические черты мужчин.
Продукция тестостерона регулируется лютеинизирующим гормоном аденогипофиза по механизму обратной связи. Повышенное содержание в крови тестостерона тормозит выработку лютропина, сниженное — ускоряет. Созревание сперматозоидов происходит под влиянием ФСГ. Клетки Сертоли, наряду с участием в сперматогенезе, синтезируют и секретируют в просвет семенных канальцев гормон ингибин, который тормозит продукцию ФСГ.
Недостаточность продукции мужских половых гормонов может быть связана с развитием патологического процесса в паренхиме яичек (первичный гипогонадизм) и вследствие гипоталамо-гипофизарной недостаточности (вторичный гипогонадизм). Различают врожденный и приобретенный первичный гипогонадизм. Причинами врожденного являются дисгенезии семенных канальцев, дисгенезия или аплазия яичек. Приобретенные нарушения функции яичек возникают вследствие хирургической кастрации, травм, туберкулеза, сифилиса, гонореи, осложнений орхита, например при эпидемическом паротите. Проявления заболевания зависят от возраста, когда произошло повреждение яичек.
При врожденном недоразвитии яичек или при повреждении их до полового созревания возникает евнухоидизм. Основные симптомы этого заболевания: недоразвитие внутренних и наружных половых органов, а также вторичных половых признаков. У таких мужчин отмечаются небольшие размеры туловища и длинные конечности, увеличение отложения жира на груди, бедрах и нижней части живота, слабое развитие мускулатуры, высокий тембр голоса, увеличение молочных желез (гинекомастия), отсутствие либидо, бесплодие. При заболевании, развившемся в постпубертатном возрасте, недоразвитие половых органов менее выражено. Либидо часто сохранено. Диспропорций скелета нет. Наблюдаются симптомы демаскулинизации: уменьшение оволосения, снижение мышечной силы, ожирение по женскому типу, ослабление потенции вплоть до импотенции, бесплодие. Усиленная продукция мужских половых гормонов в детском возрасте приводит к преждевременному половому созреванию. Избыток тестостерона в постпубертатном возрасте вызывает гиперсексуальность и усиленный рост волос.
Эти гормоны вырабатываются в женских половых железах — яичниках, во время беременности — в плаценте, а также в небольших количествах клетками Сертоли семенников у мужчин. В фолликулах яичников осуществляется синтез эстрогенов, желтое тело яичника продуцирует прогестерон.
К эстрогенам относятся эстрон, эстрадиол и эстриол. Наибольшей физиологической активностью обладает эстрадиол. Эстрогены стимулируют развитие первичных и вторичных женских половых признаков. Под их влиянием происходит рост яичников, матки, маточных труб, влагалища и наружных половых органов, усиливаются процессы пролиферации в эндометрии. Эстрогены стимулируют развитие и рост молочных желез. Кроме этого эстрогены влияют на развитие костного скелета, ускоряя его созревание. За счет действия на эпифизарные хрящи они тормозят рост костей в длину. Эстрогены оказывают выраженный анаболический эффект, усиливают образование жира и его распределение, типичное для женской фигуры, а также способствуют оволосению по женскому типу. Эстрогены задерживают азот, воду, соли. Под влиянием этих гормонов изменяется эмоциональное и психическое состояние женщин. Во время беременности эстрогены способствуют росту мышечной ткани матки, эффективному маточно-плацентарному кровообращению, вместе с прогестероном и пролактином — развитию молочных желез.
При овуляции в желтом теле яичника, которое развивается на месте лопнувшего фолликула, вырабатывается гормон — прогестерон. Главная функция прогестерона — подготовка эндометрия к имплантации оплодотворенной яйцеклетки и обеспечение нормального протекания беременности. Если оплодотворение не наступает, желтое тело дегенерирует. Во время беременности прогестерон вместе с эстрогенами обусловливает морфологические перестройки в матке и молочных железах, усиливая процессы пролиферации и секреторной активности. В результате этого в секрете желез эндометрия возрастают концентрации липидов и гликогена, необходимых для развития эмбриона. Гормон угнетает процесс овуляции. У небеременных женщин прогестерон участвует в регуляции менструального цикла. Прогестерон усиливает основной обмен и повышает базальную температуру тела, что используется в практике для определения времени наступления овуляции. Прогестерон обладает антиальдостероновым эффектом. Концентрации тех или иных женских половых гормонов в плазме крови зависят от фазы менструального цикла.
Овариально-менструальшлй (менструальньш) цикл (см. также)
Менструальный цикл обеспечивает интеграцию во времени различных процессов, необходимых для репродуктивной функции: созревание яйцеклетки и овуляцию,
периодическую подготовку эндометрия к имплантации оплодотворенной яйцеклетки и др. Различают яичниковый цикл и маточный цикл. В среднем весь менструальный цикл у женщин продолжается 28 дней. Возможны колебания от 21 до 32 дней. Яичниковый цикл состоит из трех фаз: фолликулярной (с 1-го по 14-й день цикла), овуляторной (13-й день цикла) и лютеиновой (с 15-го по 28-й день цикла). Количество эстрогенов преобладает в фолликулярной фазе, достигая максимума за сутки до овуляции. В лютеиновую фазу преобладает прогестерон. Маточный цикл состоит из 4 фаз: десквамации (продолжительность 3-5 дней), регенерации (до 5-6-го дня цикла), пролиферации (до 14-го дня) и секреции (от 15 до 28-го дня). Эстрогены обусловливают пролиферативную фазу, во время которой происходит утолщение слизистой оболочки эндометрия и развитие его желез. Прогестерон способствует секреторной фазе.
Продукция эстрогенов и прогестерона регулируется гонадотропными гормонами аденогипофиза, выработка которых увеличивается у девочек в возрасте 9-10 лет. При высоком содержании в крови эстрогенов угнетается секреция ФСГ и ЛГ аденогипофизом, а также гонадолиберина гипоталамусом. Прогестерон тормозит продукцию ФСГ. В первые дни менструального цикла под влиянием ФСГ происходит созревание фолликула. В это время увеличивается и концентрация эстрогенов, которая зависит не только от ФСГ, но и ЛГ. В середине цикла резко возрастает секреция ЛГ, что приводит к овуляции. После овуляции резко повышается концентрация прогестерона. По обратным отрицательным связям подавляется секреция ФСГ и ЛГ, что препятствует созреванию нового фолликула. Происходит дегенерация желтого тела. Падает уровень прогестерона и эстрогенов. Центральная нервная система участвует в регуляции нормального менструального цикла. При изменении функционального состояния ЦНС под влиянием различных экзогенных и психологических факторов (стресс) менструальный цикл может нарушаться вплоть до прекращения менструации.
Недостаточная продукция женских половых гормонов может возникнуть при непосредственном воздействии патологического процесса на яичники. Это так называемый первичный гилогонодизм. Вторичный гипогонадизм встречается при снижении продукции гонадотропинов аденогипофизом, в результате чего наступает резкое уменьшение секреции эстрогенов яичниками. Первичная недостаточнось яичников может быть врожденной вследствие нарушений половой дифференцировки, а также приобретенной в результате хирургического удаления яичников или повреждения инфекционным процессом (сифилис, туберкулез). При повреждении яичников в детском возрасте отмечается недоразвитие матки, влагалища, первичная аменорея (отсутствие менструаций), недоразвитие молочных желез, отсутствие или скудное оволосение на лобке и под мышками, евнухоидные пропорции: узкий таз, плоские ягодицы. При развитии заболевания у взрослых недоразвитие половых органов менее выражено. Возникает вторичная аменорея, отмечаются различные проявления вегетоневроза.
(Visited 372 times, 1 visits today)
Заместительная гормональная терапия связана с повышенным риском возникновения острого панкреатита, установили ученые. Результаты новейшего исследования были опубликованы в журнале Canadian Medical Association Journal.
Острый панкреатит – это внезапное острое воспаление ткани поджелудочной железы и
ее распад (некроз). Среди острых хирургических заболеваний органов брюшной
полости занимает третье место, уступая лишь острому аппендициту и острому
холециститу.
В поджелудочной железе вырабатываются основные ферменты, полностью расщепляющие
белки, жиры и углеводы пищи. В норме в железе эти ферменты находятся в
неактивном состоянии, а активируются только, попав в просвет кишки; при этом
катализаторами (активаторами) панкреатических ферментов служат желчь и кишечный
сок. При остром панкреатите вследствие тех или иных причин происходит активация
ферментов в самой поджелудочной железе. Они-то и повреждают тканевые структуры
органа. К развитию острого панкреатита ведут такие патологические процессы, как
перевозбуждение секреции железы, расстройства оттока панкреатического сока, а
также изменение его химических свойств.
Несмотря на применение методик консервативного и оперативного лечения, общая
летальность составляет от 7 до 15 %, при деструктивных формах – от 40 до 70 %.
В ходе новейшего исследования, которое проходило с 1997 по 2010 годы,
специалисты проанализировали состояние 31 494 шведских женщин в постменопаузе в
возрасте 48 лет.
На момент исследования 13 113 (42%) женщин проходили лечение, 3660 (12%)
испытуемых уже прошли терапию. При этом 6795 (52%) проходили терапию от приливов
при менопаузе, 4148 (32%) – местную терапию от вагинальной сухости и 2170 (16%)
женщин – обе терапии.
В результате анализа было установлено, что заместительная гормональная терапия
увеличивает риск возникновения острого панкреатита в 1,5 раза.
Ученые полагают, что причиной возникновения острого панкреатита является
экзогенный эстроген, который вводится в организм при заместительной
гормонотерапии.
Колебания гормонов, и, в особенности, эстрогена, во время менопаузы меняет
работу всего организма. Этот период сопровождается неприятными симптомами:
приливы жара, ночная потливость, головокружение, нарушения сна и эмоциональные
расстройства. Симптомы возникают из-за снижения концентрации гормонов в крови,
которые, кроме регуляции собственно половых функций, защищают организм от
множества заболеваний. Лекарства с эстрогеном улучшают кровообращение половых
органов и восстанавливают плотность и эластичность тканей вульвы и влагалища у
женщин в период менопаузы.
Однако ученые подчеркивают, что в некоторых случаях заместительная
гормонотерапия может привести к серьезным заболеваниям, в том числе к острому
панкреатиту и раку молочной железы.
По материалам ANI
Подготовил Владислав Воротников
Если вы заметили орфографическую, стилистическую или другую ошибку на этой странице, просто выделите ошибку мышью и нажмите Ctrl+Enter. Выделенный текст будет немедленно отослан редактору
Поджелудочная железа – важная составляющая пищеварительной системы человека. Она является главным поставщиком ферментов, без которых невозможно полноценное переваривание белков, жиров и углеводов. Но выделением панкреатического сока ее деятельность не ограничивается. Особые структуры железы – островки Лангерганса, которые выполняют эндокринную функцию, секретируя инсулин, глюкагон, соматостатин, панкреатический полипептид, гастрин и грелин. Гормоны поджелудочной железы участвуют во всех видах обмена, нарушение их выработки ведет к развитию серьезных заболеваний.

Эндокринная часть поджелудочной железы
Клетки поджелудочной железы, синтезирующие гормональноактивные вещества, называются инсулоцитами. Они расположены в железе скоплениями – островками Лангерганса. Общая масса островков составляет всего 2% от веса органа. По строению различают несколько типов инсулоцитов: альфа, бета, дельта, РР и эпсилон. Каждая разновидность клеток способна образовывать и секретировать определенный вид гормонов.
Какие гормоны вырабатывает поджелудочная железа
Перечень панкреатических гормонов обширный. Одни описаны очень подробно, а свойства других изучены еще недостаточно. К первым относится инсулин, считающийся самым изученным гормоном. К представителям биологически активных веществ, исследованных недостаточно, можно отнести панкреатический полипептид.
Инсулин
Особые клетки (бета-клетки) островков Лангерганса поджелудочной железы синтезируют гормон пептидной природы, получивший название инсулин. Спектр действия инсулина широк, но основное его назначение – понижение уровня глюкозы в плазме крови. Влияние на обмен углеводов реализуется благодаря способности инсулина:
- облегчать поступление глюкозы в клетку путем повышения проницаемости мембран;
- стимулировать усвоение глюкозы клетками;
- активировать образование в печени и мышечной ткани гликогена, являющегося основной формой хранения глюкозы;
- подавлять процесс гликогенолиза – расщепления гликогена до глюкозы;
- тормозить глюконеогенез – синтезирование глюкозы из белков и жиров.
Но не только метаболизм углеводов является сферой приложения гормона. Инсулин способен влиять на белковый и жировой обмен через:
- стимуляцию синтеза триглицеридов и жирных кислот;
- облегчение поступления глюкозы в адипоциты (жировые клетки);
- активизацию липогенеза – синтеза жиров из глюкозы;
- торможение липолиза – расщепления жиров;
- угнетение процессов распада белка;
- повышение проницаемости клеточных мембран для аминокислот;
- стимуляцию синтеза белка.
Инсулин обеспечивает ткани запасами потенциальных источников энергии. Его анаболический эффект приводит к увеличению депо белка и липидов в клетке и определяет роль в регуляции процессов роста и развития. Кроме того, инсулин влияет на водно-солевой обмен: облегчает поступление калия в печень и мышцы, способствует удержанию воды в организме.
Главным стимулом образования и секреции инсулина является рост уровня глюкозы в сыворотке крови. К увеличению синтеза инсулина также приводят гормоны:
- холецистокинин;
- глюкагон;
- глюкозозависимый инсулинотропный полипептид;
- эстрогены;
- кортикотропин.
Поражение бета-клеток ведет к нехватке или отсутствию инсулина – развивается сахарный диабет 1-го типа. Кроме генетической предрасположенности, в возникновении этой формы заболевания играют роль вирусные инфекции, стрессовые воздействия, погрешности питания. Инсулинорезистентность (невосприимчивостью тканей к гормону) лежит в основе диабета 2-го типа.

Глюкагон
Пептид, производимый альфа-клетками островков поджелудочной железы, называется глюкагоном. Его действие на человеческий организм противоположно действию инсулина и заключается в повышении уровня сахара в крови. Основная задача – поддержание стабильного уровня глюкозы в плазме между приемами пищи, выполняется за счет:
- расщепления гликогена в печени до глюкозы;
- синтеза глюкозы из белков и жиров;
- угнетения процессов окисления глюкозы;
- стимуляции расщепления жиров;
- образования кетоновых тел из жирных кислот в клетках печени.
Глюкагон повышает сократительную способность сердечной мышцы, не влияя на ее возбудимость. Результатом является рост давления, силы и частоты сердечных сокращений. В стрессовых ситуациях и при физических нагрузках глюкагон облегчает скелетным мышцам доступ к энергетическим запасам и улучшает их кровоснабжение благодаря усилению работы сердца.
Глюкагон стимулирует высвобождение инсулина. При инсулиновой недостаточности содержание глюкагона всегда повышено.
Соматостатин
Пептидный гормон соматостатин, вырабатываемый дельта-клетками островков Лангерганса, существует в виде двух биологически активных форм. Он подавляет синтез многих гормонов, нейромедиаторов и пептидов.
Соматостатин, кроме того, замедляет всасывание глюкозы в кишечнике, снижает секрецию соляной кислоты, моторику желудка и секрецию желчи. Синтез соматостатина возрастает при высоких концентрациях глюкозы, аминокислот и жирных кислот в крови.
Как сохранить здоровье поджелудочной железы: 5 советов
Враги фигуры: 9 продуктов, усиливающих аппетит
Гастрин
Гастрин – пептидный гормон, кроме поджелудочной железы вырабатывается клетками слизистой оболочки желудка. По количеству аминокислот, входящих в его состав, различают несколько форм гастрина: гастрин-14, гастрин-17, гастрин-34. Поджелудочная железа секретирует в основном последний. Гастрин участвует в желудочной фазе пищеварения и создает условия для последующей кишечной фазы посредством:
- увеличения секреции соляной кислоты;
- стимуляции выработки протеолитического фермента – пепсина;
- активизации выделения бикарбонатов и слизи внутренней оболочкой желудка;
- усиления моторики желудка и кишечника;
- стимуляции секреции кишечных, панкреатических гормонов и ферментов;
- усиления кровоснабжения и активации восстановления слизистой оболочки желудка.
Стимулируют выработку гастрина, на который влияет растяжение желудка при приеме пищи, продукты переваривания белков, алкоголь, кофе, гастрин-высвобождающий пептид, выделяемый нервными отростками в стенке желудка. Уровень гастрина растет при синдроме Золлингера – Эллисона (опухоль островкового аппарата поджелудочной железы), стрессе, приеме нестероидных противовоспалительных препаратов.
Определяют уровень гастрина при дифференциальной диагностике язвенной болезни и болезни Аддисона – Бирмера. Это заболевание еще называют пернициозной анемией. При нем нарушение кроветворения и симптомы анемии вызваны не дефицитом железа, что встречается чаще, а нехваткой витамина В12 и фолиевой кислоты.
Грелин
Грелин продуцируют эпсилон-клетки поджелудочной железы и специальные клетки слизистой оболочки желудка. Гормон вызывает чувство голода. Он взаимодействует с центрами головного мозга, стимулируя секрецию нейропептида Y, ответственного за возбуждение аппетита. Концентрация грелина перед приемом пищи растет, а после – снижается. Функции грелина разнообразны:
- стимулирует секрецию соматотропина – гормона роста;
- усиливает выделение слюны и готовит пищеварительную систему к приему пищи;
- усиливает сократимость желудка;
- регулирует секреторную активность поджелудочной железы;
- повышает уровень глюкозы, липидов и холестерола в крови;
- регулирует массу тела;
- обостряет чувствительность к пищевым запахам.
Грелин координирует энергетические потребности организма и участвует в регуляции состояния психики: депрессивные и стрессовые ситуации повышают аппетит. Кроме того, он оказывает действие на память, способность к обучению, процессы сна и бодрствования. Уровень грелина увеличивается при голодании, похудении, низкой калорийности пищи и уменьшении содержания глюкозы в крови. При ожирении, сахарном диабете 2-го типа отмечается снижение концентрации грелина.

Панкреатический полипептид
Панкреатический полипептид является продуктом синтеза РР-клеток поджелудочной железы. Его относят к регуляторам пищевого режима. Действие панкреатического полипептида на процессы пищеварения следующее:
- угнетает внешнесекреторную активность поджелудочной железы;
- сокращает выработку панкреатических ферментов;
- ослабляет перистальтику желчного пузыря;
- тормозит глюконеогенез в печени;
- усиливает пролиферацию слизистой оболочки тонкой кишки.
Секреции панкреатического полипептида способствует богатая белком пища, голодание, физические нагрузки, резкое падение уровня сахара крови. Снижают выделяемое количество полипептида соматостатин и глюкоза, введенная внутривенно.
Вывод
Нормальное функционирование организма требует слаженной работы всех эндокринных органов. Врожденные и приобретенные заболевания поджелудочной железы ведут к нарушению секреции панкреатических гормонов. Понимание их роли в системе нейрогуморальной регуляции помогает успешно решать диагностические и лечебные задачи.
Видео
Предлагаем к просмотру видеоролик по теме статьи.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник статьи: http://kancler32.ru/jestrogeny-i-podzheludochnaja-zheleza/
Эстрогены: роль в норме и в патогенезе заболеваний
Эстрогены — это группа стероидных гормонов, которые играют ключевую роль в развитии и функционировании репродуктивной системы, а также оказывают значительное влияние на сердечно-сосудистую, опорно-двигательную, иммунную и нервную системы.
В организме гормон имеет три формы: 17β-эстрадиола (эстроген Е2) и его метаболиты — эстрон (Е1) и эстриол (Е3). Важно заметить, что именно эстрадиол (Е2) обладает наибольшим сродством к основному эстрогеновому рецептору ER-α, другие же являются более слабыми агонистами. Вырабатываются эстрогены в основном яичниками и яичками (хотя и не только), мишенью служат клетки самых разнообразных тканей — молочных желез, мочеточника, яичников, яичек, простаты, костной ткани, а также сердечно-сосудистой, нервной и иммунной систем [1].
Биосинтез эстрогенов
В организме женщины в пременопаузе эстрогены синтезируются из холестерола преимущественно в яичниках, также в большом количестве вырабатывается плацентой. Гораздо меньшее количество эстрогенов образуется в негонадных органах — печени, сердце, коже и мозге.
Как уже было сказано выше, наибольшую биологическую активность проявляет 17β-эстрадиол, или просто эстрадиол, или Е2. Именно он является основным продуктом пути биосинтеза эстрогенов и играет наибольшую роль в пременопаузном периоде.
Цепочка превращений из холестерола в Е2 выглядит следующим образом:
Холестерол → прегненолон → прогестерон → андрогены → эстрадиол
Е1 — эстрон — проявляет себя в основном в постменопаузе, синтезируется в адипоцитах.
Е3 — эстриол, обладает наименьшим эффектом, синтезируется из Е1 (через промежуточные вещества) в плаценте, играет ключевую роль при беременности.
Одним из важнейших ферментов, участвующих в метаболизме эстрогенов, является ароматаза. Она относится к цитохром-p450-суперсемейству и широко распространена в клетках различных тканей. Ферменту не чужда определенная тканеспецифичность, которая достигается альтернативным сплайсингом, специфичными для некоторых тканей промоторами и факторами транскрипции. Функция ароматазы – обеспечить последнюю реакцию превращения предшественника эстрогена в активный 17β-эстрадиол.
Биосинтез эстрогенов сильно отличается у женщин репродуктивного возраста и у женщин в постменопаузе или в дорепродуктивном возрасте; особенно выражены отличия в способе функционирования. Эстрадиол, производимый яичниками женщинами в пременопаузе, выходит в кровоток и оказывает системное действие. В случае, когда гормон синтезируется в негонадных органах, он обычно реализует свое действие местно.
Так, обнаружена высокая активность ароматазы в остеобластах и остеокластах – эстрогены оказывают значительное влияние на морфогенез костной ткани (см. ниже). Также гормон синтезируется в мужских яичках, он крайне необходим для созревания сперматозоида.
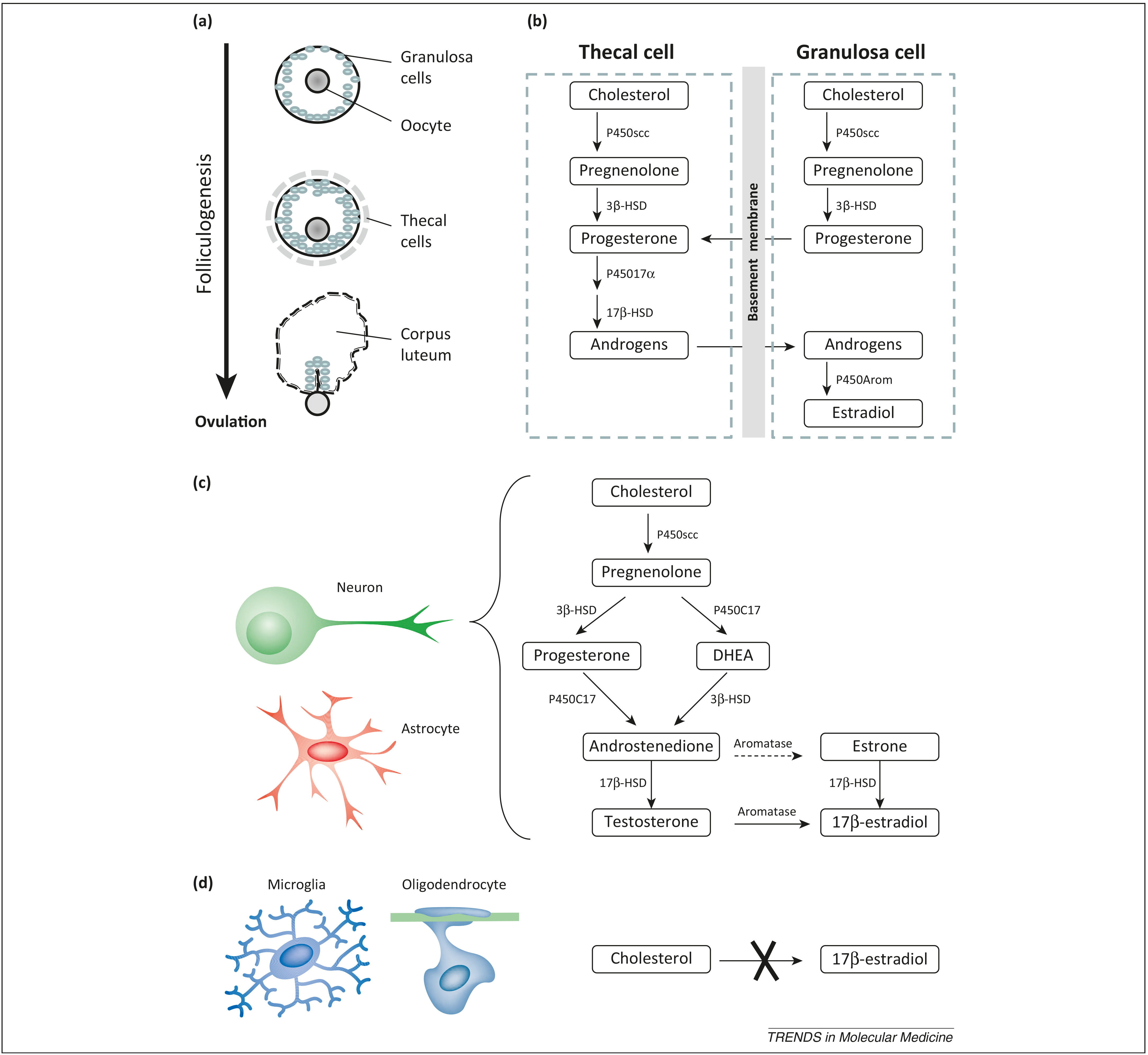
Биосинтез эстрадиола в яичниках. На рис. 1 показаны основные стадии метаболизма гормона, который происходит в тека-клетках и гранулезных клетках (как мы помним, фолликул в яичнике содержит ооцит 1-го порядка, его окружают гранулезные клетки, а поверх — тонким слоем тека-клетки).
В растущем фолликуле происходит «содружественный» биосинтез эстрогенов — тека-клетки не могут из андрогенов в итоге получить эстрогены, а гранулезные клетки — не могут из прогестерона синтезировать андрогены. Поэтому происходит определенный обмен промежуточными веществами между клетками.
Данный механизм является тканеспецифичным, его активность зависит от репродуктивного статуса.
Биосинтез эстрадиола в головном мозге. Как ни странно, лучше всего метаболизм эстрогенов изучен в яичниках и мозге. Цепочка, представленная на рис. 1, имеет место в гиппокампе, гипоталамусе, миндалевидном теле, хвостатом ядре, таламусе, мозжечке и даже коре головного мозга.
В этом случае также имеет место тканеспецифичный механизм – нейроны способны продуцировать эстрогены из тестостерона или холестерола, циркулирующих в крови; но к этому абсолютно неспособны клетки микроглии и олигодендроциты [2].
Рис. 1. Биосинтез эстрогенов в яичниках и мозге.
(а) Фолликулогенез. Примордиальный фолликул состоит из ооцита и слоя гранулезных клеток в начале фолликулогенеза. Клетки Тека формируют слой, окружающих гранулезные клетки, когда фолликул активируется. В конце фолликулогенеза клетки Тека становятся частью желтого тела.
(b) Тканеспецифичный синтез эстрогенов в яичнике. Продукция эстрогенов начинается с синтеза прегненолона из холестерола, катализирует реакцию фермент расщепления боковой цепи семейства цитохрома-p450 (p450-scc). Прегненолон далее превращается в прогестерон ферментом 3β-гидроксистероиддегидрогеназа (3β-HSD) в клетках Тека и гранулезных клетках. Прогестерон превращается в андрогены с помощью еще одного фермента семейства p450. И уже из андрогенов фермент ароматаза образует эстрадиол.
(с) Тканеспецифичный биосинтез эстрогенов в мозге. В нейронах содержатся все ферменты, необходимые для синтеза эстрогенов. (d) Клетки микроглии и олигодендроциты неспособны синтезировать эстрогены [2].
Рецепторы эстрогенов
Еще в 50-х годах прошлого столетия Элвуд Дженсен описал белок, который связывает этот гормон; сегодня он известен как рецептор эстрогенов типа α — ER-α (estrogen receptor). Достаточно долгое время считалось, что лишь ER-α активируется эстрогенами, пока в 1996 году не был обнаружен еще один рецептор, названный ER-β [3].
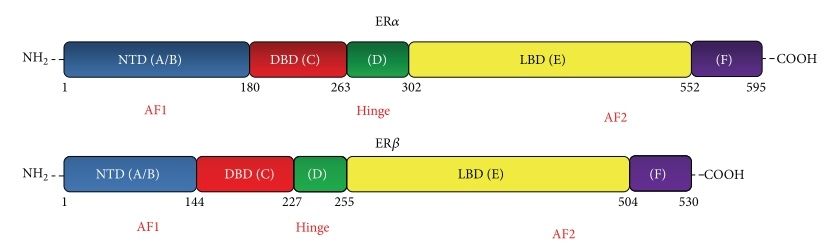
Оба белка относятся к суперсемейству ядерных, или нуклеарных, рецепторов (NR — nuclear receptor) и имеют порядковый номер NR3A1 (ERα) и NR3A2 (ERβ). Они достаточно неодинаковы, кодируются разными генами, по-разному представлены в органах и тканях и отличаются по выполняемым функциям (Рис. 2)
В строении рецептора выделяют следующие функциональные участки:
- А/В-домен — N-концевой. Представлен наиболее вариабельным участком, ответственным за лиганд-независимую активацию транскрипции (AF-1 — activation function);
- C-домен — ДНК-связывающий, также называемый DNB (DNA-binding domain);
- D-домен — своеобразный «шарнир» между С- и Е-участками (hinge);
- E-домен или LBD — лиганд-связывающий (ligand-binding domain). Участок играет важную роль в димеризации, а также имеет функциональную область AF-2, отвечающий за лиганд-зависимую активацию транскрипции;
- F-домен — C-концевой, отвечает за общую модуляцию работы рецептора, участвует в белок-белковых взаимодействиях.
Рис. 2. Функциональные отличия в структуре ERα и ERβ [4].
Следует заметить, что рецепторы эстрогена также насчитывают некоторые подвиды, отличающиеся по своему строению. Так, ERα насчитывает несколько изоформ, разнящиеся по строению некоторых функциональных участков [5]; как это влияет на их функцию — вопрос дискутабельный.
Механизмы функционирования эстрогеновых рецепторов
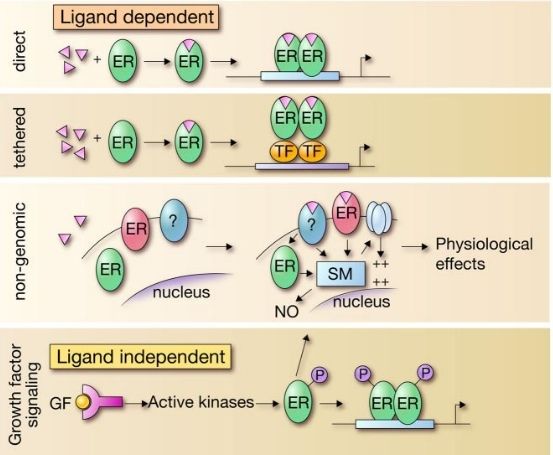
В настоящее время выделяют четыре общих механизма реализации рецепторами своей функции (см. рис. 3). Это — прямой (direct), «классический» механизм; связанный с другими факторами транскрипции (TF), негеномный механизм регулирования и особняком выделяют лиганд-независимую активацию эстрогеновых рецепторов [5]. Имеет смысл разобрать каждый подробнее.
Рис. 3. Виды функционирования эстрогеновых рецепторов в клетке [5].
Классический механизм — самая обыкновенная активация рецептора лигандом (гормоном), который вместе с белками-корегуляторами как-то изменяет экспрессию отдельных генов.
Вторая модель несколько сложнее. Здесь рецептор взаимодействует с комплексом других факторов транскрипции, которые модулируют влияние рецептора на экспрессию гена. Это также очень важный регуляторный механизм.
Третий вид функционирования назван «негеномным», так как не затрагивает геном напрямую. Он гораздо менее изучен и реализует себя через определенный каскад реакций (на сегодняшний день неизвестных), следствием чего является изменение клеточной функции в виде открытия/закрытия ионных каналов, изменения концентрации NO в клетке. Эта модель опосредует «быстрые реакции», т. е. ответ на стимул происходит за считанные секунды. Предполагается, что в этом могут участвовать ER, непосредственно связанные с клеточной мембраной, а не свободно плавающие в цитоплазме; также есть гипотезы, что это вообще неэстрогеновые рецепторы (хотя и активируются эстрадиолом).
Предыдущие три механизма функционирования рецептора называют «лиганд-зависимыми», так как рецептор реагирует на гормон. Четвертый — лиганд-независимый способ активации рецептора — не предполагает участия специфического гормона. Любое высокоактивное вещество (например, фактор роста — GF — grows factor) связывается с мембранными рецепторами; это вызывает каскад разнообразных реакций, активацию протеинкиназ, которые, взаимодействуя уже с рецепторами эстрогена, фосфорилируют его; хотя имеются гипотезы, что протеинкиназы взаимодействуют не с ER, а с белками-корегуляторами [5].
Рецептор ER-α
Это — первый из двух обнаруженных типов рецептора к эстрогенам; он преимущественно синтезируется в органах и тканях репродуктивной системы — молочные железы, матка, шейка матки, влагалище и пр. [6].
Как и большинство рецепторов к стероидным гормонам, рецепторы эстрогена осуществляют свою функцию путем активации/деактивации экспрессии различных генов (геномная функция). Однако помимо этого существует и негеномная роль рецептора, которая проявляет себя гораздо быстрее, нежели произойдет реализация наследственной информации (как уже было упомянуто выше). Рецепторы, находясь в цитоплазме, могут связываться с аденилатциклазой, протеинкиназами, запуская определенный каскадный процесс. Именно негеномные функции эстрогеновых рецепторов представляют наибольший интерес для современных исследователей [1].
Например, эстрогеновый рецептор инициирует транскрипцию и в AP-1-сайтах (кодирующих белки AP-1) [7] с помощью комплекса белков-активаторов и репрессоров. AP-1 (activation proteins) представляют собой семейство различных факторов транскрипции, которые играют важную роль в регуляции клеточной цикла, димеризации и общей жизнеспособности клетки [8].
Рецептор ER-β
В 1996 году был выделен новый подтип рецептора к эстрогену, который получил название ER-β [3]. Исследователи изучили строение данного белка и выяснили, что он в целом достаточно гомологичен альфа-рецептору; однако имеются и отличия (см. рис. 4). Если кратко – высококонсервативный ДНК-связывающий домен практически идентичен (96% сходство), лиганд-связывающий – всего 58 % одинаковой структуры; остальные участки молекулы совершенно не совпадают или вовсе отсутствуют, как видно из рисунка 2. Этим же исследованием было продемонстрировано, что ER-β также активируется эстрадиолом, хотя сродство к нему несколько меньше, нежели у ER-α.
В отличие от ERα, данный подтип экспрессируется преимущественно в яичниках, яичках, простате, тимусе, селезенке, легких и гипоталамусе [6].
Рис. 4. Отличия в аминокислотной последовательности рецепторов ER-α и ER-β [3].
Рецептор GPER
В том же 1996 году был обнаружен еще один рецептор, который назвали «G-связанный рецептор» — GPR30 [9]. Во многих источниках этот белок фигурирует именно под таким названием, хотя официально в 2007 году ему присвоили звание самостоятельного G-связанного эстрогенового рецептора — GPER (G-protein coupled estrogen receptor) [10].
GPER – 7-сегментный доменный трансмембранный рецептор, который отвечает за особые реакции, которые названы «быстрыми эффектами» (англ. rapid effects), активируя различные каскадные сигнальные пути. Именно он отвечает за «негеномные» функции эстрогена. GPER связан с плазматической мембраной, а также с ЭПС и комплексом Гольджи, широко распространен в клетках печени, сердца, кишечника, яичников, ЦНС, поджелудочной железы, иммунокомпетентных клетках, адипоцитах и клетках репродуктивной системы [11].
Еще один новый эстрогеновый рецептор?
Не успели ученые опомниться от предыдущих открытий, как в 2002 году была опубликована статья [12], авторы которой уведомили об открытии нового эстрогенового рецептора, который назвали ER-X. Он связан с плазматической мембраной и в большой концентрации определяется в матке и головном мозге. Однако статья видится мне довольно сомнительной: авторы объясняют, почему обнаруженный ими рецептор не является ни альфа-, ни бета-подтипом, но в исследовании совершенно не упоминается GPER (который, как мы помним, тогда назывался GPR30).
На сегодня имеется очень скудный перечень литературы по данному вопросу. ER-X вскользь упоминается в обзоре 2013 года [2]; в это же самое время (в том же месяце – марте) опубликована другая статья, где говорится уже о нескольких новых рецепторах ER-X и ER-x [13], правда, автор вежливо называет их «кандидатами» на роль эстрогеновых рецепторов.
Как бы там ни было, пока что нет единого мнения, отнести ли обнаруженные новые рецепторы к эстрогенам, какую функцию они выполняют, и вообще – действительно ли это «новые» рецепторы, а не методологическая ошибка.
Рецепторы эстрогенов и морфогенез
Суть морфогенеза, осуществляемого под влиянием эстрогеновых рецепторов, напрямую вытекает из предыдущего раздела. ER (или корегуляторы, взаимодействующие с ними), могут активироваться различными факторами роста – именно в этом и состоит суть регуляции ER в развитии целого ряда тканей и органов.
Прежде всего, эстрогеновые рецепторы важны для нормального развития молочных желез и простаты. Морфогенез в этом случае опосредован действием на рецепторы определенных факторов роста и рецепторов к ним, среди которых можно выделить:
- Рецептор к эпидермальным факторам роста (EGFR-1 – epidermal grows factor receptor) необходим для развития эпителиальной и соединительной тканей, тканевой репарации, участвует в ангиогенезе, задействован в опухолевом росте;
- Эпидермальный фактор роста (EGF – epidermal grows factor);
- Трансформирующий фактор роста (TGF- α – transforming grows factor);
- Бетацелюлин;
- Гепарин-связывающий эпидермальный фактор роста (HP-EGF – heparin binding epidermal grows factor);
- Фактор роста фибробластов (FGF)
- Амфирегулин;
- Эпирегулин.
Все данные факторы роста активируют указанный выше рецептор EGFR-1, который, по-видимому, играет ключевую роль в морфогенезе вышеуказанных тканей и органов. Также все данные биологически активные вещества синтезируются в виде предшественников и нуждаются в частичном протеолизе с помощью комплекса каталитических белков [5]. Разумеется, весь спектр своих функций факторы роста осуществляют, взаимодействуя также и с другими рецепторами; но в данном случае нас интересует именно EGFR-1.
Молочные железы
В эксперименте [14] на мышах с нокаутом гена, отвечающего за экспрессию ERα, было установлено, что у животного без данного рецептора не происходит удлинения протоков молочной железы. Несмотря на нормальную работу гипофиза и адекватную выработку половых гормонов, у мышей без ERα развивались «усеченные» молочные железы.
Эмпирически было выяснено, что рецептор ERα оказывает влияние на выработку амфирегулина, который, активируя уже известный нам EGFR-1, обеспечивал нормальное развитие молочных желез [5].
Существует еще одна важная функция эстрогеновых рецепторов в ткани молочной железы – это сообщения эпителиальных и мезенхимальных клеток между собой, а также клеточная адгезия.
Из-за этого свойства ERα играет важную роль в онкогенезе. На культуре раковых клеток MCF7 было выявлено, что ERα участвует в перестройке актиновых филаментов, сообщая клетки между собой и клетки с внеклеточным матриксом.
С течением онкогенеза изменяется экспрессия многих белков интегринов, молекул адгезии и протеинов, участвующих в миграции и метастазировании. Особая роль принадлежит катгеринам и катенинам (гормон-зависимым белкам адгезии), которые выполняют, с одной стороны, защитную роль, являясь супрессорами для онкогенеза; с другой – некоторые из них позволяют отличить один вид рака от другого. Так, Е-кадгерин синтезируется в большом количестве при ERα-позитивном раке МЖ, тогда как Р-кадгерин определяется при ERα-негативном низкодифференцированном раке [5, 15].
ERβ в свою очередь влияет на дифференцировку железистых эпителиоцитов; отсутствие рецептора приводит к таким дефектам как отсутствие межклеточного матрикса, отсутствие базальной пластинки, увеличение интерэпителиального межклеточного пространства. Это происходит из-за снижения выработки гормонзависимых молекул адгезии – Е-кадгерина, коннексина и других [5].
Вспомним знаменитый скандал с диэтилстильбэстролом – ДЭС (или просто стильбэстролом). У беременных женщин, которые принимали ДЭС по показаниям, рождались дети с различными аномалиями урогенитального тракта (независимо от пола детей).
В этом исследовании [16] ученые изучали, как ДЭС будет влиять на развитие простаты у мышей с нокаутом ERα (ERKO-α – estrogen receptor knockout), нокаутом ERβ (ERKO-β ) и обычной немутантной мыши. У двух последних (ERKO-β и обычная мышь) развивались разнообразные нарушения в морфогенезе простаты, тогда как мышь с нокаутом ERα оказалась резистентна к действию препарата. Таким образом была установлена ключевая роль ERα в морфогенезе простаты.
Что рецепторы делают физиологически, в нормальном организме? Костные морфогенетические белки (bone morphogenic factor — BMP, принадлежат к суперсемейству трансформирующих факторов роста-β) секретируются в строме органа, замедляя ветвление и рост простаты. Особая роль принадлежит BMP7, который ингибирует сигнальный путь Notch [17]. Данная сигнальная система была открыта лишь недавно, на сегодняшний момент известно, что Notch крайне важен для регуляции развития клетки, ее пролиферации и апоптоза.
ERα в свою очередь увеличивают экспрессию особого белка фоллистатина в железистом эпителии; фоллистатин оказывает ингибирующее влияние на BMP7 [5]. Соответственно, Notch-сигнальная система работает, и морфогенез идет нормальным путем.
Роль ERβ в морфогенезе простаты, по-видимому, не так значительна, хотя дефект этого рецептора приводит к нарушениям вентральной доли простаты. Основное значение ERβ – ограничение роста простаты путем активации трансформирующих факторов роста TGF-β (последние ингибируют EGF и тестостерон-зависимый рост железы) [5].
В этом органе в большом количестве секретируется ERβ, который играет ключевую роль в развитии и созревании фолликулов. В эксперименте ERKO-β мышь была субфертильна, в яичниках таких животных находится большое количество атретических фолликулов. При стимуляции гонадотропином, все же происходила выработка небольшого количества ооцитов – предполагается участие в этом ERα, которые, вероятно, обеспечивают частичную компенсацию утраченной функции [18].
И вновь обратимся к мышкам ERKO-α и ERKO-β, у которых имеется ряд нарушений в развитии такого важного органа. У ERKO-α мышки матка в общем сохраняет свою структуру, однако имеет место ярко выраженная гипоплазия – вес органа едва достигает половины от нормального веса и размера матки здоровой особи. Строма между эндометрием и миометрием гипотрофична, менее организована; маточные железы редкие и негустые. Эпителиоциты кажутся вполне здоровыми, несмотря на это, в эндометрии вместо призматического эпителия (в норме) преобладает кубический. Зато матка ERKO-β мыши абсолютно нормальна – орган вполне функционален, претерпевает циклические гормон-зависимые изменения [19].
Костная система
В развитии костной ткани однозначно необходима роль ERα; не так давно был обнаружен мужчина с мутацией данного гена, имеющий незакрепленные эпифизы костей и низкую прочность самой кости из-за сниженного количества минералов. Терапия эстрадиолом эффекта не дала [18]. Подобные данные для β-рецептора на сегодняшний день отсутствуют.
Нервная система
Не так давно стало известно, что эстрогены оказывают огромное влияние на развитие головного мозга, рост аксонов и ветвление дендритов, опосредуют сексуальное поведение, память и обучение [5]. Механизмы этих явлений достаточно сложны; известно, что эстрогены регулируют фактор роста нервной ткани (NGF – nerve growth factor) и его рецепторы в холинергических нейронах; TGF-β в гипоталамусе, нейротрофический фактор мозга (brain-derived neurotrophic factor, BDNF) в коре; инсулиноподобный фактор роста и его рецепторы в гипоталамусе.
Оба вида рецептора широко представлены в клетках ЦНС, как выяснили исследователи, изучавшие мозг мыши [20]. Они имеют различную локализацию и «плотность», а функции их не ограничиваются лишь формированием сексуального поведения.
GPER. Как выяснилось, он тоже достаточно активно представлен в ЦНС и определяется во многих структурах переднего, среднего, продолговатого отделов мозга, а также гипофизе, гипоталамусе и гиппокампе [21]. Однако поскольку GPER – самый молодой из представленных рецепторов, мы почти ничего не знаем о его роли в морфогенезе.
Некоторые патологии и заболевания, связанные с метаболизмом эстрогена и функционированием эстрогеновых рецепторов
1. Ожирение
Эстроген играет достаточно значимую функцию в липидном обмене, особенно выражено его действие у женщин в пременопаузе. В отношении распределения подкожной жировой клетчатки выражен половой диморфизм; имеются данные, что именно эстрадиол участвует в развитии жировой клетчатки по «женскому» типу.
Основные рецепторы, запускающие процесс липолиза в организме – α2- и β-адренорецепторы; воздействуя на ERα, эстроген увеличивает количество и плотность этих рецепторов у женщин репродуктивного возраста, что обеспечивает нормальный жировой обмен [22].
Особая роль в этом вопросе принадлежит GPER. В серии опытов на мышах с нокаутом гена GPER было выяснено, что GPER-КО особи весили значительно больше, а подкожная жировая клетчатка была гораздо более выражена. Более того, у таких мышей был повышен уровень холестерола и триглицеридов в крови, а также, как следствие, имел место неалкогольный стеатоз печени [11].
Кроме этого, гормон Е2 играет важную роль в формировании аппетита, усиливая синтез лептина и холецистокинина – эти вещества способны оказать угнетающее воздействие на аппетит. В эксперименте было установлено, что опосредует связь между Е2 и этими гормонами все три типа рецепторов – ERα и ERβ, представленные в некоторых ядрах гипоталамуса [22]; также в ЦНС широко представлен GPER, который, в отличие от остальных эстрогеновых рецепторов, по-видимому, усиливает аппетит. В опытах на мышах GPER-КО особи были гораздо менее чувствительными к лептину и холецистокинину (однако это касается лишь особей женского пола) [11].
Исходя из вышеизложенного, менопауза (и снижение выработки эстрогена) – тот самый «переходный» момент, после которого женщина автоматически относится к группе риска по ожирению, а также ряда некоторых других нарушений (см. ниже). Существуют попытки профилактики ожирения (и ряда других заболеваний) заместительной терапией, однако на сегодня еще нет необходимой доказательной базы, подтверждающей ее эффективность.
2. Сахарный диабет
Достаточно сложные отношения гормона Е2 и инсулина. В исследованиях было показано, что женщина в постменопаузе встречается с крайне высоким риском развития метаболического синдрома, диабета, ожирения. Данные эффекты были продемонстрированы в опытах на ERKO-α мышах – из-за дефицита эстрогенового рецептора типа альфа у мышей наблюдалась инсулинорезистентность, гиперинсулинемия, гиперлипидемия; в случае же нокаута гена ERβ – подобных нарушений не было, более того, имело место некоторое усиление чувствительности к инсулину и толерантности к глюкозе. То есть, можно сказать, что именно с ERα связано большинство проблем [4].
На практике все оказывается несколько сложнее. Многочисленные исследования, описанные в статье 2017 года [23], показывают, что мы знаем слишком мало, чтобы делать какие-то выводы. Имеются достаточно противоречивые данные по поводу менопаузы и риска развития диабета 2 типа; эстроген-заместительная терапия и вовсе показала свою неэффективность в качестве профилактического средства в этом случае.
По-прежнему остается неясным множество вопросов касательно регуляции эстрогеновыми рецепторами уровня инсулина и глюкозы; и для снижения риска развития диабета 2 типа все так же предлагается лишь адекватная диета и поддержание ИМТ в пределах нормы.
3. Рак молочных желез
Существуют различные механизмы развития этого заболевания, не связанные с изменением гормонального фона (например, мутации генов BRCA1 и BRCA2), однако во многих случаях существенную роль в канцерогенезе играет менопауза и снижение количества циркулирующих эстрогенов [24].
В серии исследований было выяснено, что эстрадиол в ткани молочной железы способен превращаться в генотоксические, потенциально канцерогенные, формы. У мышей с нокаутом ERα было выявлено существенное снижение частоты возникновения опухолей; оофорэктомия также задерживала канцерогенез. Этим же эффектом обладает препарат летрозол – ингибитор ароматазы [25].
Эти данные могут существенно повлиять на терапию ER+ опухолей молочных желез, однако механизмы канцерогенеза и точная роль эстрогена (и эстрогеновых рецепторов) на сегодня остается невыясненной.
4. Болезнь Альцгеймера
Это наиболее известное нейродегенеративное заболевание, причиной которого, как считается, является накопление и агрегация β-амилоида в головном мозге. Исследования показывают, что риск развития болезни Альцгеймера связан со снижением концентрации половых гормонов с возрастом; причем чаще заболеванию подвергаются женщины в постменопаузе, нежели мужчины того же возраста [26].
Чтобы разобраться в этом, нужно немного остановиться на деталях. Существуют особые ферменты — β-секретаза (BACE1) и γ- секретаза, которые и синтезируют из белка-предшественника амилоида (БПА) — β-амилоид, приводящий к развитию заболевания. β-амилоид могут утилизировать инсулин-разрушающий фермент (IDE – insulin-degrading enzyme) и фермент неприлизин (NEP – nephrilysin – вырабатывается эндотелием сосудов, участвует в деактивации предсердного натрий-уретического пептида). Именно эти два фермента повышают свою активность под действием эстрогенов; в этом же причина накопления амилоида при снижении выработки эстрадиола [27].
Далее происходит беспрепятственное накопление β-амилоида в клетке, что приводит к извращению функции митохондрии – она начинает продуцировать большое количество активных форм кислорода, в результате клетка входит в состояние т.н. «окислительного стресса», что в конечном итоге заканчивается ее гибелью [26].
В отношении профилактики болезни Альцгеймера очень популярна идея заместительной эстрогено-терапии – существует множество попыток, некоторые из них довольно успешны. Исследования показывают, что, если начать заместительную терапию примерно в момент наступления менопаузы – риск возникновения болезни будет заметно снижен; если затянуть лет на 10-15 — не получим никакого эффекта [2].
Однако эти данные, как считают некоторые исследователи (достаточно обоснованно) – в некотором роде излишне оптимистичны [28]. Многие источники изобилуют различными исследованиями о нейропротекторной функции эстрогена, надеясь, что гормоно-заместительная терапия поможет сохранить когнитивные способности. Авторы критического обзора справедливо замечают, что большинство исследований проводится на мышах, тогда как их нейрофизиология мышей существенно отличается от человеческой; к тому же термин «когнитивные способности» — крайне сложен, так же, как и патогенез многих нейродегенеративных заболеваний. Так что на данный момент можно говорить лишь о предпосылках к созданию новых методик лечения, да и то с осторожностью.
5. Болезнь Паркинсона
Еще одно распространенное нейродегенеративное заболевание; в отличие от болезни Альцгеймера, в этом случае женщины имеют более низкий риск. При этом заболевании страдает в большей степени стриатум и черное вещество – структуры, где экспрессируются все три типа эстрогеновых рецепторов; наиболее выражено влияние ERα, который обеспечивает протекцию дофаминергических нейронов [2].
Имеются данные, что эстрадиол, воздействуя на все три типа рецепторов мозга, способен оказать существенное нейропротекторное действие у особей обоих полов; разрабатываются стратегии, способные применить эти данные в терапии болезни Паркинсона, однако все они еще нуждаются в подтверждении [29].
6. Сердечно-сосудистые заболевания
В этом вопросе женщины репродуктивного возраста имеют огромное преимущество. Активация ERα у мышей связана с более низкой степенью поражения сосудов атеросклерозом; эстроген путем воздействия на ERβ способен предотвратить кардиофиброз. А рецептор GPER способен уменьшить ишемическое поражение и сохранить функцию сердца в норме [2]. К сожалению, все эти преимущества сходят на нет с возрастом или оофорэктомией, а эффективность использования эстроген-заместительной терапии в качестве профилактики и лечения на сегодняшний день не доказана.
Источник статьи: http://medach.pro/post/1884